- Substancias puras: están formadas por un solo compuesto. El hierro está formado solo por hierro el cobre por cobre.
 |
| Cobre |
- Mezclas: están formadas por dos o más substancias puras. El agua de mar tiene agua, sal, bicarbonato, bromuro...
-Tipos de mezclas- Homogéneas: son las que sus componentes no se pueden identificar a simple vista. Una importante es el aire que tiene O, CO2, N, vapor de agua y otros gases.
 |
| En el chocolate, sus componentes no se ven a simple vista |
- Heterogéneas: son las que sus componentes se pueden distinguir a simple vista. Algunos ejemplos son la sopa, el agua con aceite, arena y garbanzos...
 |
| Aquí se distinguen a simple vista los componentes: agua y aceite |
-Separación de mezclas- Filtración: sirve para separar mezclas heterogéneas de liquidos y solidos. Al pasarlo por un filtro. el sólido no lo puede traspasar y queda ahí.
 |
| Sistema de filtración |
- Decantación: sirve para separar mezclas heterogéneas de dos líquidos que no se mezclan, como el agua y el aceite. Se deja reposar para que un componente descienda. Después se hecha a otro vaso o se separa con un embudo de decantación.
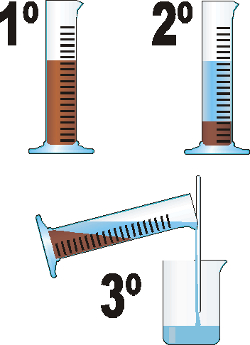 |
| Decantación |
 |
| Decantación por embudo |
- Centrifugación: Sirve para separar sólidos en suspensión de un líquido. La mezcla se hace girar a gran velocidad en una centrifugadora, y las partículas de sólido descienden y forman un sedimento.
- Separación magnética: sirve para separar mezclas con acero o hierro. Se pasa el imán por la mezcla y recoge las limaduras metálicas.
 |
| Separación magnética |
- Cromatografía: separa mezclas de tintes o colorantes. Si se pone la tinta en un papel poroso, y este sobre alcohol, el alcohol irá ascendiendo sobre el papel, arrastrando los componentes del tinte.
 |
| Cromatografía |
- Destilación: separa mezclas de líquidos homogéneos, cuyos puntos de ebullición sean diferentes. Al calentar la mezcla, se vaporará primero el líquido que tenga el punto de ebullición más bajo. El vapor del líquido se recogen en un condensador, que los enfría y los vuelve a pasar a líquido.
 |
| Destilación |
-Disoluciones:Las disoluciones son mezclas homogéneas. Las disoluciones se componen de:
- Disolvente: parte más abundante y en la que se disuelve el soluto.
- Soluto: partes que están en menor proporción, y que son disueltas en el disolvente.
También tienene estas propiedades:
- Solubilidad: máxima cantidad de soluto que se puede disolver en un disolvente. (Esto depende de la temperatura y del disolvente).
- Concentración: cantidad de soluto que hay disuelto en la disolución. Si se dice que la disolución tiene poca concentarción, o está poco concentrada, significa que tiene poco soluto. Hay varios tipos de concentración:
- Diluida: está poco concentrada.
- Concentrada: mayor concentración de soluto.
- Saturada: mayor concentración de soluto que puede admitir.
 |
| Concentracion diluida y concentrada |










