 |
| Elemento de la tabla periódica con sus partes |
-Número atómico y número másico
- Número atómico (Z): es el número de protones que tiene un átomo (todos en el núcleo). Todos los átomos de un elemento, tienen SIEMPRE el mismo número de protones.
Por ejemplo, el hidrógeno tiene SIEMPRE 1 protón; el helio SIEMPRE 2; el carbono SIEMPRE 6; el oxígeno SIEMPRE 8; y el uranio SIEMPRE 92.
- Número másico (A): es el número total de partículas que hay en el átomo, es decir la suma de protones y neutrones.
Para averiguar el número de neutrones de un átomo solo hay que restarle el número atómico (número de protones), al número másico (número de neutrones y protones)------> Neutrones= A-Z
A diferencia del número másico, el número atómico aparece siempre en la tabla periódica, cuando el número másico, no, y ahora veremos porque.
-Isótopos
Ya dijimos antes que los átomos de un elemento, tienen SIEMPRE el mismo número de protones, pero se ha comprobado que hay átomos de un mismo elemento que tienen masas diferentes. Ya que el número de protones es SIEMPRE el mismo, y por ello el número de electrones también es el mismo (porque se anulan), solo hay una explicación: el número de neutrones es variable.
 |
| Para simbolizar un isótopo se indica el símbolo del elemento, su número másico y atómico. Así, el carbono-14 (Z=6, A=14) se representa de esa manera |
Los isótopos son aquellos átomos que tienen el mismo número atómico, pues SIEMPRE es el mismo, pero diferente número másico, pues el número de neutrones varía.
Por ello no se pone el número másico en la tabla periódica junto a cada elemento, porque no es un valor fijo.
Para identificar los isótopos de un mismo elemento se utiliza una notación simbólica en la que se indica, además del símbolo del elemento, su número atómico y másico.
Así, existe el níquel-58 (A=58) que tendrá menos materia que el níquel-60 o el níquel-62.
Abundancia isotópica natural
La mayoría de los elementos químicos están formados por más de un isótopo. El porcentaje de cada uno de los isótopos que hay en la naturaleza es la abundancia isotópica natural del elemento. Si la abundancia natural isotópica del níquel-58 es del 68,27% y la del níquel-60 es del 26,1%, eso significa que de 100 kilos de níquel que coja, 68,27 kg serán de níquel-58, y 25,1 kg serán de níquel-60.
-Masa de los átomos y de los elementos
La masa de los átomos es muy pequeña, por lo que resulta conveniente utilizar una unidad de masa que sea del mismo orden de magnitud, es decir, que sea también muy pequeña.
Por convenio se ha establecido, como unidad de masa atómica, uma, la doceava parta de la masa de un átomo de carbono-12:
masa de 1 átomo de carbono-12 = 12 uma --> 1 uma = 1,660 · 10-27 kgComo ya vimos, los isótopos son variaciones de los neutrones del átomo de un mismo elemento, por lo que el átomo que tenga mas neutrones, tendrá mayor masa. La masa y la abundancia de los isótopos del oxígeno son:
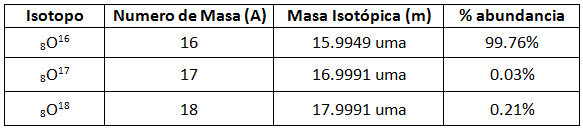 |
Ya dijimos que en la tabla periódica no aparecía en cada elemento el número másico debido a que hay átomos de un mismo elemento con distinto número de neutrones, los isótopos. Lo que si se pone en la tabla periódica es la media ponderada de los isótopos de este elemento, respecto a sus abundancias naturales.
A partir de la tabla sabemos que por cada 100 átomos de oxígeno, 99,76 lo son de oxígeno-16; 0,03 son de magnesio-17 y 0,21, de magnesio-18. La masa total de los 100 átomos se obtiene sumando el producto de las masas atómicas y las abundancias naturales:
15,9949· 99,76 + 16,9991 · 0,03 + 17,9991 · 0,21La masa media se obtiene dividiendo la masa de los 100 átomos entre 100:


No hay comentarios:
Publicar un comentario